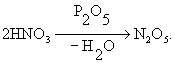
Дегидратация (от де... и греч. hуdor — вода), отщепление воды от органических или неорганических соединений. Д. может быть осуществлена термически (большей частью в присутствии катализаторов) или химически, при действии дегидратирующих агентов (веществ, связывающих воду). Примером Д. является образование этилена из этилового спирта при пропускании его через нагретую до 300—400°C трубку с окисью алюминия (катализатор) или при нагревании до 170°C с концентрированной серной кислотой (дегидратирующее вещество):
CH3 — CH2OH ® CH2 = CH2 + H2O.
Образование этилена — пример внутримолекулярной Д. При нагревании же избытка спирта с серной кислотой до 140°C происходит главным образом межмолекулярная Д. с образованием диэтилового эфира:
CH3CH2 — O — H + H — O — CH2CH3 ®
® CH3CH2 — O — CH2CH3 + H2O.
Внутримолекулярная Д. уксусной кислоты CH3COOH даёт кетен CH2 = C = O, а межмолекулярная — уксусный ангидрид (CH3CO)2O. Д. амидов кислот CH3CONH2 приводит к нитрилам CH3C º N. Примером Д. неорганического вещества может служить образование азотного ангидрида из азотной кислоты под действием пятиокиси фосфора:
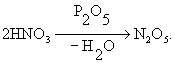
К Д. относятся также процессы удаления кристаллизационной воды из кристаллогидратов и удаления воды, связанной за счёт сил адсорбции; в этих случаях обычно применяют термин «обезвоживание». Д. — процесс, обратный гидратации.
Б. Л. Дяткин.