Миоглобин (от мио... и глобин), глобулярный белок, осуществляющий в мышцах запасание (депонирование) молекулярного кислорода и передачу его окислительным системам клеток. М. — первый белок, структура которого выяснена методом рентгеноструктурного анализа (Дж. Кендрю и сотрудниками, 1957—60). Состоит из одной полипептидной цепи (около 70 % из 153 остатков аминокислот включено в спирализованные участки). Как и в гемоглобине, активным центром молекулы М., связывающим O2, является гем. Молекулярная масса М. 17 000. По пространственной структуре М. сходен с b-цепью гемоглобина (см. схему). Обратимое связывание М. с O2 происходит уже при низких парциальных давлениях кислорода PO2 Это имеет большое физиологическое значение: при сокращении мышц PO2 резко падает в результате сжатия капилляров; именно в этот момент происходит высвобождение из М. кислорода, необходимого работающей мышце. В мышцах позвоночных животных (М. определяет их цвет) содержится около 2 % М. на сухую массу ткани; в мышцах морских животных (тюлень, кит, дельфин и др.), способных длительно находиться под водой, — до 20 %. См. также Белки, Биополимеры, Мышцы.
Лит.: Верболович П. А., Миоглобин и его роль в физиологии и патологии животных и человека, М., 1961; Кендрью Дж. С., Миоглобин и структура белков, «Биофизика», 1963, т. 8, № 3.
В. О. Шпикитер.
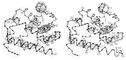
Схема пространственной структуры миоглобина (справа) и бета-цепи гемоглобина (слева). Чёрными кружками указано положение каждого десятого остатка аминокислоты, прямые тяжи — спирализованные участки; группа гема представлена в виде диска.