
Изонитрилы
(хим.), или карбиламины
RNC (где R = CH 3, C2H5 или вообще С n Н 2n + 1, также C 3H5, C6H5 и т.п. алкогольные радикалы) — особый класс азотистых органических соединений, изомерных нитрилам. Они открыты Готье (1866 г.), который получил их при взаимодействии синеродистого серебра AgCN (2 частицы) с йодюрами спиртов (1 частица); при этом получается двойное соединение AgCN с образовавшимся И.:
2AgCN + CH3J = AgJ + CH3NC.AgCN
которое затем при перегонке с раствором цианистого калия разлагается, освобождая И. Для суждения о строении И. важна реакция, состоящая в действии спиртоватого едкого кали на смесь первичных аминов с хлороформом, помощью которой И. были получены Гофманном почти одновременно с Готье:
C2H5NH2 + CHCl3 + 3KHO = C2H5NC + 3KCl + 3H2O.
Благодаря характерным свойствам И. (запах), эта реакция применяется, как качественная, для распознавания первичных аминов. Далее, И. образуются в малом количестве, как побочный продукт, при получении нитрилов перегонкою солей серно-эфирных кислот или йодюров спиртов с цианистым калием, а также и при некоторых других реакциях. И. представляют летучие жидкости отвратительного запаха, вызывающего тошноту, более легкие, чем вода, и в ней несколько растворимые. Из них известны метилизонитрил или метилкарбиламин СH 3 NC (т. к. 59,6°), этилкарбиламин C2H5 NC (т. к. 78,1°), изопропилкарбиламин (т. к. 87°), фенилкарбиламин С 6H5NC (т. к. 167°) и др. И. щелочами не изменяются, но водными минеральными кислотами с чрезвычайной легкостью разлагаются на амины и муравьиную кислоту, а также и одною водою при 180°, например:
CH3NC + 2H2O = CH3NH2 + CH2O2.
Реакция представляет один из видов гидратации (присоединения воды), и при действии органических кислот останавливается на промежуточном продукте, замещенном формамиде, напр.:
C2H5NC + H2O = C2H5NHOCH.
При взаимодействии с уксусной кислотой при этом образуется уксусный ангидрид, так что И. оказываются способными действовать водоотнимающим образом:
CH3NC + 2C2H4O2 = CH3NHOCH + (C2H3O)2O.
При действии окиси ртути или окиси серебра фенилкарбиламин окисляется, переходя в изоциановый эфир фенила:
C6H5NC + O = C6H5NCO.
Фенилкарбиламин соединяется также с серой при нагревании, превращаясь в соответствующее горчичное масло:
C6H5NC + S = C6H5NCS.
Вообще И. обнаруживают большую склонность вступать в прямые соединения со многими веществами. Так, они соединяются (в отсутствии воды) с хлористым водородом, образуя солеобразные, но легко разлагаемые водой, вещества, напр. 2C 2H5 NC 3HCl; дают кристаллические двойные соединения с синеродистым серебром; соединяются с йодюрами (CH 3J, C2H5 J); этилкарбиламин прямо соединяется с бромом в C 2H5NC.Br2 (тяжелое, нелетучее масло, от влажности разлагающееся) и т. д.
По своему строению И., будучи изомерны нитрилам (см.) и подобно последним заключая в своем составе одноэквивалентную углеводородную группу R', соединенную с группой циана CN, отличаются тем, что в то время как в нитрилах группа R' связана непосредственно с углеродом циана, в И., наоборот, она находится в связи с его азотом. Это выражают следующими формулами:
Фактические основания для такого представления дают реакции распадения этих
соединений. Именно, И. при гидратации (см. выше) распадаются, выделяя
углеводородную группу в связи с азотам в виде амина, при чем атом углерода циана
отщепляется в форме частицы муравьиной кислоты; при гидратации же нитрилов
углеводородная группа выделяется вместе с атомом углерода циана, образуя частицу
одноосновной кислоты R'СОНО, а азот освобождается отдельно от углерода в виде
аммиака NH 3.
Связь углеводородной группы с азотом в И. усматривается и из их реакций
образования при взаимодействии хлороформа с первичными аминами. Что касается
вопроса о способе связи отдельно стоящего атома углерода И. с азотом, то он
понимается различно. Одни принимают этот углерод двухатомным и согласно сему
изображают И. структурной формулой: R'-N=С, другие при четырехатомности этого
углерода допускают в И. присутствие двух свободных сродств: R-N=С=; большинство
же считает И. за производные не трех, а пятиатомного азота и приписывают им
формулу: 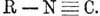
П. П. Рубцов. Δ .