Криогидрат*
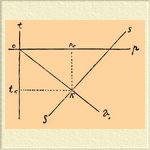
— раствор, застывший целиком без предварительного разложения на составные части. Если охлаждать раствор, то, смотря по его составу, выделяется одна из его составных частей. Напр., водный раствор соли выделяет при охлаждении или лед, если раствор содержит много воды, или соль, если раствор крепок. Выделяя одну из составных частей при охлаждении, раствор изменяется в составе и содержание другой составной части в нем увеличивается. При достаточном охлаждении должен, следовательно, неизбежно наступить момент, когда раствор сделается насыщенным и по отношению к другой составной части. Ниже этой температуры должны выделяться в твердом виде обе составные части раствора. Это и будет температура образования К. Раствор данного состава можно охладить и ниже температуры образования К., если избегнуть прикосновения к раствору составных его частей в твердом виде. При этом раствор будет представлять свойства переохлажденных жидкостей: малейшая крупинка одной из составных частей раствора, брошенная в твердом виде, вызывает быстрое повышение температуры раствора и выделение массы твердого тела. Выделяется та составная часть раствора, которой крупинка брошена. Если бросить одновременно крупинки обеих составных частей раствора, то температура подымается до температуры образования К. и остается постоянной при дальнейшем замораживании раствора, причем и состав раствора при замерзании не меняется. Если приготовить предварительно раствор установившегося указанным путем состава, то это и будет раствор, могущий застывать целиком при постоянной температуре и без изменения состава, образуя К. При нагревании К. наблюдаются признаки определенного химического соединения: во все время плавления К. температура остается постоянной и все порции раствора, образовавшегося при плавлении, имеют тот же состав, что и К. Несмотря на указанные признаки, большинство ученых считает К. смесью отвердевших составных частей раствора. Этому противоречат некоторые наблюдения Гутри, впервые изучившего К. Переохладив водный раствор бертолетовой соли, он наблюдал, что кристаллы льда и соли, брошенные отдельно в раствор, не вызывают образования К., а выделяют лед, всплывающий наверх, и соль, оседающую на дно; К. же образуется от крупинки нацело замерзшего раствора соли. Гутри получал К. также в виде больших кристаллов, без признаков неоднородности массы. Механической смесью К. считать нельзя еще и потому, что плавление его наступает при температуре, более низкой, чем температура плавления каждой из составных частей. Известно, что два твердых тела, могущих образовать раствор, будучи смешаны в твердом виде, плавятся при температуре низшей, чем температура плавления каждого тела в отдельности, следовательно, имеет место взаимодействие. На этом основано действие охладительных смесей, из коих смесь льда и соли, могущая дать температуру-23°, пользуется широким практическим применением. Низшая температура, которая может быть получена при помощи данной охладительной смеси, соответствует температуре образования (или темпер. плавления) К. Найти эту температуру для данной пары тел, а также состав К., можно, зная кривые, выражающие зависимость между процентным составом раствора и теми температурами, при которых раствор насыщен по отношению к одной из составных частей. Отношение этих кривых видно из прилагаемой фиг.
На оси абсцисс нанесено процентное содержание тела S в растворе, а на оси ординат — температуры насыщения. Кривая о v — отвечает насыщению тела (предполагается вода: кривая пересекает 0°). Кривая SS — отвечает насыщению тела S. Пересечение кривых определяет температуру образования и состав К., ибо раствор состава, отвечающего точке пересечения кривых, насыщен одновременно для обеих составных частей раствора. На фиг. представлен случай водного раствора и потому температура образования К. ниже 0°. Состав К. не установлен с достаточной точностью, вследствие трудности освободить К. совершенно от избытка одной из составных частей раствора. По имеющимся данным, К. не могут быть выражены простыми частичными формулами. Из фигуры видно, что состав К. определяется главным образом расстоянием от оси ординат кривой SS, т. е. кривой растворимости соли. Чем больше растворимость соли вблизи 0°, тем меньше воды должен содержать К. С другой стороны можно считать, что самый ход обеих кривых определяется положением точки k, т. е. составом и температурой образования К. Изучение К. должно много способствовать разъяснению вопроса о растворах и растворимости. Это изучение представляет, однако, значительные трудности, ибо в К. мы имеем дело с весьма деликатными формами взаимодействия. Многие К., как это наблюдал еще Гутри, выделяются, напр., в льдоподобных массах и становятся при дальнейшем охлаждении окрашенными в цвет, близкий к цвету входящей в их состав соли.
Д. Коновалов.