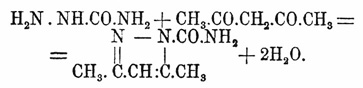
Семикарбазид
— CH5ON3, иначе гидразид карбаминовой кислоты H 2N.CO.NH.NH2, получен впервые Тиле при гидролизе слабыми кислотами (или щелочами) аминогуанидина (cм.):
HN:C(NH.NH2)(NH2) + Н 2 О = NH3 + OC(NH.NH2)(NH2);
уловить образование С. при этой реакции удается только с помощью бензойного альдегида, образующего трудно растворимый бензалсемикарбазид —
С 6H5.СН:N.NН.СО.NН 2.
Почти одновременно С. наблюден Курциусом и Гейденрейхом при нагревании (3 часа) в запаянных трубках эквимолекулярной смеси мочевины (см.) и гидрата гидразина (см.):
NH2.NH2.H2O + NH2.CO.NH2 = NH2.CO.NH.NH2 + NH3 + H2O.
Тиле и Гейзер нашли затем С. между продуктами восстановления нитромочевины (см.) цинковой пылью на холоде к выделили его в виде двойного соединения хлористого цинка с ацетонсемикарбазоном [(СН 3)2:С:N.NH.CO.NH 2]2ZnCl2
а Тиле и Штанге синтезировали С., действуя на холоде на серно-кислый гидразин (13 г), растворенный в воде (100 куб. см) и нейтрализованный сухой содой (5,5 г) и небольшим избытком (8,8 г) циановокалиевой соли; при стоянии (12 ч.) выделяется небольшое количество гидразокарбонамида
NH2.CO.NH.NH.CO.NH2
количество которого увеличивается при подкислении раствора; кислый фильтрат дает при взбалтывании с бензойным альдегидом почти количественный выход бензалсемикарбазида (см. выше). Этой реакцией С. и получается теперь с той лишь разницей, что, как показали Тиман и Крюгер, удобнее осаждать не бензалсемикарбазид, а ацетонсемикарбазон; для этого фильтрат от гидразокарбонамида необходимо слегка подщелочить и взбалтывать с ацетоном; ацетонсемикарбазон перекристаллизовывают из спирта, обрабатывают теоретическим количеством серной кислоты и получающуюся серно-кислую соль С. промывают спиртом. С. кристаллизуется в бесцветных призмах, плав. при 96°С; он легко растворим в воде и спирте; восстанавливает жидкость Фелинга (см. Крахмал, прим.) и аммиачный раствор азотно-кислого серебра на холоде. Водные растворы при энергичном нагревании с кислотами распадаются на аммиак, гидразин и углекислоту:
CH5ON3 + Н 2 О = NН 3 + N2H4 + СО 2;
на холоде и особенно при действии кислот на спиртовые растворы С. удается получить его соли; описаны: хлористо-водородная
NH2.CO.NH.NH2.HCl
кристаллизующаяся из слабого спирта в больших призмах, плав. при 173°С с разложением, очень легко растворимая с кислой реакцией в воде, трудно в крепкой соляной кислоте и почти не растворимая в абсолютном спирте и эфире; азотно-кислая
CH5ON3.HNO3 + H2O
— призмы, легко растворимые в воде и трудно в спирте, плав. ок. 65°С в кристаллизационной воде, а в безводном состоянии с разложением при 123°С (Тиле и Штанге) — 125°С (Курциус и Гейденрейх). Серно-кислая соль
CH5OH3.H2SO4
кристаллизуется в прекрасных, больших призмах, плав. при 144°; очень легко растворима в воде, не растворима в абсолютном спирте. При долговременном нагревании при 120°С распадается на гидразодикарбонамид и серно-кислый гидразин (Тиле и Штанге). Почти то же распадение претерпевает и сам С. при нагревании (Курциус, Фингер, Тиле): наряду с гидразокарбонамидом [Гидразокарбинамид можно потому рассматривать, как биурет семикарбазида (Курциус)] удается наблюдать образование свободного гидразина:
2NH2.CO.NН.NH 2 = H2N.CO.NH.NH.CONH2 + N2H4;
усложняется, однако, реакция тем, что большая часть гидразина распадается при этом на аммиак и азот:
6H2N.CO.NHN2 = 4NН 2 + 3H2NCO.NH.NH.CONH2 + N2.
Свободный и уксусно-кислый С. являются довольно важными реактивами на альдегиды и кетоны (Тиле), особенно потому, что карбазиды и карбазоны почти все хорошо кристаллизуются (Байер). Реакцию получения их ведут таким образом. Растворяют хлористо-водородный С. в небольшом количестве воды, прибавляют теоретическое количество спиртового раствора уксусно-калиевой соли и альдегида (кетона), и воды (или спирта) до образования однородного раствора; продолжительность реакции колеблется между несколькими минутами и 4 — 5 сутками; конец узнается по тому, что вода при прибавлении к спиртовому раствору осаждает вполне кристаллическое вещество; при выпадении масла должно иметь в виду, что оно может закристаллизоваться по прошествии некоторого времени, а иногда и нескольких часов (Байер). Зелинский с той же целью растворяет 20 г хлористо-водородного С. и 20 г С 2 Н 3 О 2 К в 60 г воды и взбалтывает раствор с кетоном (альдегидом) на холоде до прекращения образования труднорастворимого осадка; в том случае, когда он не образуется, прибавляют несколько капель метилового спирта (без ацетона!); перекристаллизованные из древесного спирта семикарбазоны (азиды) вполне чисты. Замечательно (Зелинский), что температуры плавления различных семикарбазонов довольно близки друг к другу; так, семикарбазон ацетона (см. выше) пл. при 186° — 187°, а семикарбазоны: β-метилкетопентаметилена — при 184° — 185°, β -метилкетогексаметилена — при 180° — 181°, αα-диметилкетопентаметилена (II) при 184° — 185°, αα-диметилкетогексаметилена (II) — при 183° — 184°; кетогексаметилена — при 166° — 167° и кетогептаметилена (суберона) — при 163° — 164° и т. д., а потому С. может служить главным образом для изолирования из продуктов реакции кетонов (альдегидов) и для очистки их. С дикетонами С. реагирует несколько иначе, чем с монокетонами; так Буво, действуя С. на ацетонилацетон, получил диметилпиразолмочевину, плав. при 107—108°:
Кроме нескольких десятков семикарбазонов и карбазидов, описанных разными наблюдателями, получены Тиле многочисленные семикарбазоны хинонов. Известны еще продукты действия на него HCN, HNО 2 и т. д.
A.И. Горбов. Δ .