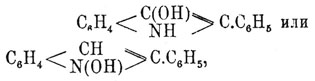
Фенилкарбимид
карбанил, фенилизоцианат или фенилизоциановый эфир — CO=N—С 6 Н 5 (см. Изоциановые эфиры) — получается обыкновенно при действии фосгена на расплавленный карбанилид или на хлористоводородную соль анилина:
NH2 —С 6 Н 5—HCl + COCl2 = CO=NС 6 Н 5 + 3HCl (Hentschel);
образуется также, кроме способов, указанных в ст. Изоциановые эфиры, при перегонке оксанилида C 2O2 (NH—С 6 Н 5)2 с фосфорным ангидридом Р 2O5 или самого по себе (Hofmann), при действии пятихлористого фосфора PCl 5 на оксаниловую кислоту и перегонке получающегося при этом ее хлорангидрида Cl—CO—CO—NH—С 6 Н 5 (Aschan), при разложении солей диазобензола в присутствии циановокaлиeвoй соли и порошковатой меди (Gattermann) и при нагревании изороданового фенила CS=N—С 6 Н 5 с окисью ртути (K ü hn u. Liebert). Ф. представляет бесцветную, сильно преломляющую свет летучую жидкость с острым, вызывающим слезы запахом, уд. весом 1,092 (при 15°) и темп. кип. 166°. Химические превращения Ф. представляют полную аналогию с превращениями жирных изоциановых эфиров (см.). Действие его на спирты, фенолы и оксимы с образованием соответствующих уретанов идет так гладко, что может служить для распознавания в соединениях присутствия алкогольных гидроксилов, а также и группы SH. Вообще Ф. чрезвычайно легко вступает в разнообразные реакции. В присутствии хлористого алюминия он прямо соединяется с ароматическими углеводородами, бензолом, и его гомологами с образованием анилидов ароматических кисл. ряда бензойной, что дает весьма удобный способ их синтеза, напр.:
CH3 —С 6 Н 5 + CO=NС 6 Н 5 = CH3 —С 6 Н 4 —СО—NHС 6 Н 5
а затем:
CH3—C6H4 —CO—NHС 6 Н 5 + Н 2O = CH3—C6H4—COOH + NH2 —С 6 Н 5 (Leuckart);
при этом группа CO—NHCH 5 всегда становится в параположение. Подобным же образом из простых эфиров фенолов с помощью Ф. синтезируются и ароматические алкоксикислоты (Leuckart u. Schmidt). Ф. с большою легкостью вступает в соединение с диазоамидами, образуя при этом своего рода сложные мочевины (Goldschmidt u. Molinari), например:
Эти сложные мочевины под влиянием кислот расщепляются на диазо-соли и симметричные двузамещенные мочевины, например:
Реакции присоединения Ф. происходят в отсутствие воды, спирта, кислот и т. п. веществ, а потому, по Гольдшмидту, не сопровождаются атомными перегруппировками и могут, следовательно, служить для определения строения. Таким образом, с помощью Ф. может быть решен вопрос о строении таутомерных диазоамидов X—N=N—NH—Y и Y—N=N—NH—X (см.), напр. диазобензолтолуидида С 6 Н 5—N=N—NH—C6H4—CH3 и диазотолуоланилида CH 3—C6H4 —N=N—NH—С 6 Н 5, ибо в первом случае при расщеплении продукта присоединения Ф. должны получиться соль диазобензола и толилфенилмочевина, согласно написанным выше равенствам, а во втором — соль диазотолуола и дифенилмочевина. С амидинами Ф. также соединяется очень легко, причем в реакцию вступают 2 мол. его, соответственно двум остаткам аммиака в молекуле амидина:
NH=R'''—NH2 + 2CO=N—С 6 Н 5 = С 6 Н 5—NH—CO—N=R'''—NH—CO=NH—C6H5.
Реакции Ф. с диазоамидами и амидинами, очевидно, вполне аналогичны реакциям его и др. изоциановых эфиров (см.) с аммиаком и аминами. Далее, Ф. образует непрочные кристаллические соединения с хлором и бромом, C 7H5ON—Cl2 и С 6 Н 3 ОN—Br 2, и очень легко полимеризуется. Дифенилкарбимид
получается из Ф. при действии на него очень небольшого количества триэтилфосфина (Hofmann) или при кипячении Ф. с пиридином (Snape) и представляет мелкие, квадратные таблички с т. пл. 175°, нерастворимые в воде и трудно растворимые в кипящем спирте; при нагревании обратно переходит в Ф., при кипячении со спиртом дает дифенилаллофановый эфир С 6 Н 5 —NH—CO—N(С 6 Н 5)—CO—OC2H5, со спиртовым аммиаком образует дифенилбиурет С 6 Н 5 —NH—CO—N(С 6 Н 5)—CO—NH2, с анилином — трифенилбиурет С 6 Н 5 —NH—СО—N(C 6H5)—CO—NH—С 6 Н 5. Три-Ф., или трифенил-изоциануровый эфир, C3O3N3 (С 6 Н 5)3 (строение см. Изоциануровые эфиры) получается (Hofmann) нагреванием при 100° Ф. (3 части) с сухой уксусно-калиевой солью (1 часть) и кристаллизуется в призмах с темп. плав. 274—275°.
П. П. Рубцов. Δ .