Целлюлоза (дополнение к статье)
— сосредоточила на себе, со стороны ее химических превращений, в последние годы усиленное внимание химиков и техников. В дополнение к сообщенному ранее мы изложим здесь вкратце то, что было опубликовано различными исследователями. Относительно действия на Ц. азотной кислоты отметим, что Knecht наблюдал образование неустойчивого нитрата уже при погружении отбеленного хлопка в холодную азотную кислоту уд. в. 1,415 на 2 минуты. Морфологические изменения, претерпеваемые при этом хлопком, оказываются весьма сходными с теми, которые наблюдаются при мерсеризации (см. Волокна растений). В процессах приготовления настоящих нитро-, а также ацетил-замещенных Ц. играет важную роль присутствие серной кислоты. Разработка этого вопроса разными авторами привела к установлению, так сказать, рациональных рецептов нитрующих кислотных смесей [Лунге: 63,35 гр. серной кислоты, 25,31 гр. азотной кислоты и 11,34 гр. воды. Сапожников: 65,8 гр. серной кислоты, 24,3 гр. азотной кислоты и 9,9 гр. воды. См. также Нитроклетчатка.]. Способы приготовления ацетил-Ц., опубликованные в 1906 г. в патентах Баденской анилиновой и содовой фабрики (1904) основаны, с одной стороны, также на применении серной кислоты и, с другой, на предварительном увлажнении (20—30%) хлопка. Получаемые продукты оказываются нацело растворимыми в хлороформе, кристаллической уксусной кислоте, анилине и друг. Применение серной кислоты сказывается, по-видимому, на составе конечного продукта, по крайней мере, в некоторых случаях. Так, по наблюдениям Hake и Lewis, оказывается, что при нитровании Ц. образуются также и эфиры серной кислоты. Эти эфиры впоследствии медленно разлагаются, переходя в более устойчивые соединения с меньшим содержанием серы; с другой стороны, появляется серная кислота. В этом нужно искать, по мнению авторов, объяснение того, что нитро-Ц., выдержавшая тщательное предварительное испытание, потом, при сохранении, разлагается и даже взрывается. Ацетилируя Ц. в присутствии серной кислоты, Cross и Bevan приготовили ряд смешанных уксусно-сернокислых эфиров. Высшим продуктом авторы считают четырехзамещенный эфир состава C 6H6O(SO4H)(OCOCH3)3. Эти данные оспариваются, однако, Green'ом, так что нельзя считать окончательно установленным, что образование эфиров натуральной Ц. идет именно до этого предела, а не останавливается на трехзамещенных. Сторонники последнего взгляда допускают образование и тетрацетата, но полагают, что этому предшествует гидролитическое изменение молекулы Ц., вызываемое условиями ацетилирования. Представляя существенный интерес для выяснения строения Ц., ацетильные производные начинают приобретать также и техническое значение, в области производства искусственных волокон. Реакции нитровании осложняются еще и другими, параллельно протекающими превращениями. Так, по данным Vignon'a оказывается, что приготовленная по способу Lunge нитрованная клетчатка представляет не что иное, как тринитроокси-Ц. состава
C24H48O45N12 = 3C6H7(NO2)3O5 + C6H7(NO2)3O6.
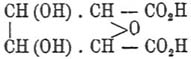
При обработке этого продукта хлористым железом получается окси-Ц. — отношение, представляющее, между прочим, характерное отличие нитро-Ц. от продуктов нитрования маннита и других многоатомных алкоголей: здесь хлористое железо регенерирует первоначальный спирт. Наконец, отметим еще, что, по данным Will'я, нитро-Ц. дает под влиянием едкого натра оксипировиноградную кислоту: CH 2(OH).CO.CO2H.
Окси-Ц., полученная действием на хлопок бертолетовой соли и соляной кислоты, была анализирована Vignon'ом и оказалась однородным соединением состава
C24H40O21 = 3C6H10O5 + C6H10O6.
При перегонке окси-Ц. с разведенной соляной кислотой Толленс получил фурфурол. При кипячении же окси-Ц. с известковым молоком образуются изосахарная кислота:
и диоксимасляная кислота (Faber, Tollens). Вместе с окси-Ц. Vignon получил растворимую Ц., в количестве 3—4 % от веса взятой сырой окси-Ц. Освобожденная от последней, растворимая Ц. представляет аморфный белый порошок, содержащий 1 % золы и 3,5 % воды. В холодной воде растворяется всего 0,02 ‰, в кипящей — 0,396 ‰. Элементарный состав оказался одинаковым с обыкновенной Ц., различие же проявилось в теплоте горения и способности к образованию фурфурола. Весьма важный вопрос о гидратировании Ц., близко касающийся, между прочим, образования ацильных производных, не получил еще надлежащей разработки. Первые стадии гидратировании имеются в мерсеризованном волокне, в осадках, выделенных из раствора Ц. в швейцеровом реактиве или из раствора вискозы. Гидратированная Ц. поддается реакциям легче, чем натуральная; она также легче растворяется в швейцеровом реактиве и в растворе хлористого цинка. Продукты гидролитического распада Ц. обнаруживают содержание СО-групп, между тем как натуральная Ц. не реагирует ни с фенилгидразином, ни с гидроксиламином. Образование гидро-Ц. следует отнести также к гидратационным процессам, но уже гораздо глубже затрагивающим частицу Ц. Гидро-Ц., полученная действием холодной серной кислоты уд. в. 1,45 на клетчатку и вполне освобожденная от кислоты, не изменяется при нагревании до 100°, как показал Stern. Потеря в весе, при указанном получении гидро-Ц., достигает 8 % и объясняется одновременным образованием декстрозы. Из превращений, которые еще более глубоко изменяют молекулу Ц., следует упомянуть о действии сухого хлористоводородного газа на холоде. Fenton нашел, что при этом образуется хлорметилфурфурол:
Gostling сообщил, что при нагревании с насыщенным раствором хлористого или
бромистого водорода в хлористом или четыреххлористом углероде до 80° различные
виды Ц. образуют хлор- или бромметилфурфурол и одновременно декстрозу. Кроме
того, остается еще до 40 % черного вещества, сохраняющего волокнистое строение
первоначальной клетчатки. По свойствам этого остатка автор сближает его с
искусственным гумусом (Sestini, Conrad), a по составу с саккульмином, которые
был приготовлен Sestini при кипячении тростникового сахара с разведенной серной
кислотой. Хотя в настоящее время не представляется еще возможным высказаться
окончательно ни о величине молекулы Ц., ни о ее структуре, тем не менее, были
опубликованы в этом направлении более или менее, вероятные предположения,
основанные на вышеперечисленных данных. Общепризнанно, что Ц. представляет
особую форму углеводов общей формулы n[(CH.OH) 3.CO.C2H4 O],
в которой остаются неопределенными как положение карбонильной группы, так и ее
характер (альдегидный, кетонный или циклокетонный), а равно и особенная функция
пятого кислородного атома. Cross и Bevan склоняются к тому, что было бы
правильнее в сложном агрегате Ц. видеть род твердого раствора, а не молекулу в
обычном смысле, но в то же время примыкают к мнению, что частица Ц. должна
содержать, по меньшей мере, 24 атома углерода, т. е. представлять учетверенный
элементарный состав C 6H10O5.
Приурочивая, однако, к последнему предположительное строение и считая доказанным
наличие четырех гидроксилов, эти авторы предлагают следующую циклокетонную
группировку: 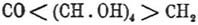 для элементарного состава; умножение последнего в действительной молекуле может
быть формулировано таким образом:
для элементарного состава; умножение последнего в действительной молекуле может
быть формулировано таким образом:
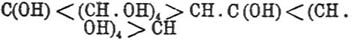 и т. д.
и т. д.
С другой стороны, Green, опираясь главным образом на результаты распада Ц., считает последнюю внутренним ангидридом глюкозы и дает отсюда для элементарного состава формулу лишь с тремя гидроксилами:
Автор считает возможным приспособить эту формулу и к высшему молекулярному весу, изменив только расположение связей кислорода, но ближе не объясняет, как именно это следует сделать.
В. Шапошников.