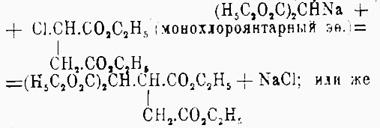
Четырехосновные органические кислоты
(хим.) — представляют вещества общей формулы C xH2y (СО 2 Н) 4 (см. Карбоксил, Углеводороды, Унитарная система), где x и y целые числа, причем y≤x- 1; известны многочисленные представители как жирных, так и ароматических Ч. органических кислот; так как ни одна из них не выделяется особенно по своим свойствам или применениям, то в настоящей статье можно ограничиться указанием общих методов получения кислот определенного строения. Кислоты общей формулы C nH2n-2 (СО 2 Н) 4 или же C nH2n-6O8, т. е. предельные, получаются обычно с помощью малонового эфира; последний может быть взят для синтеза в количестве одной или двух молекул, смотря по тому, какого рода кислоту желают иметь; в первом случае действуют: 1) двунатровым производным малонового эфира на 2 молекулы эфира моногалоидозамещенной одноосновной жирной кислоты, например:
(H5C2O2C)2CNa2 + 2Cl.CH2.CO2C2H5 (монохлороуксусный эфир) = (Н 5 С 2 О 2 С) 2 С(СН 2.СО 2 С 2 Н 5)2 + 2NaCl,
или 2) мононатрмалоновым эфиром на эфир моногалоидозамещенной двухосновной жирной кислоты, например:
или же 3) присоединяют мононатрмалоновый эфир к эфиру непредельной двухосновной кислоты, например:
Все полученные таким образом этиловые эфиры Ч. кислот могут быть перегнаны без разложения, по крайней мере под уменьшенным давлением; они жидки; при омылении дают соответственные кислоты, теряющие при нагревании молекулу СО 2 (за счет остатка малоновой кислоты) с образованием трехосновных кислот (из кислот, отвечающих приведенным выше эфирам, образуется, например, одна и та же трикарбаллиловая кислота (см. Трикарбоновые кислоты). При получении Ч. кислот за счет двух молекул малонового эфира можно: 1) на мононатриевое производное малонового эфира действовать йодом, например:
2(Н 5 С 2 О 2C)2 СНNa + I 2 = 2NaI + (Н 5 С 2 О 2 С) 2 СН. CH(СО 2 С 2 Н 5)2,
или полиметиленовыми дигалоидными производными, каковы, например CH 2I2 (йодистый метилен), C 2 Н 4Cl2 (хлористый этилен), Br(CH 2)3 Br (бромистый триметилен) и т. д. (см. Циклокислоты), или 2) можно конденсировать 2 молекулы малонового эфира с 1 молекулой какого-нибудь жирного альдегида под влиянием пиперидина, диэтиламина, иногда этиламина, аммиака (Кнёвенагель, ср. Циклокетоны):
СН 3.СНО + 2Н 2 С(СО 2 С 2 Н 5)2 + CH3.CH[HC(СО 2 С 2 Н 5)2]2 + H2 О.
Этиловые эфиры Ч. кислот такого строения тоже жидки и перегоняются под уменьшенным давлением, но метиловые эфиры некоторых из них кристалличны; так, например, тетраметиловый эфир симметричной этантетракарбоновой кислоты плавится при 135-136° (Уокер, Бишоф). Свободные кислоты кристалличны; при нагревании они теряют 2 молекулы СО 2, образуя двухосновные кислоты; например:
(НО 2 С) 2 СН.СН(СО 2 Н) 2 = 2СО 2 + HO2C.CH2.CH2.CO2 H (янтарная кислота),
(НО 2 С) 2 СН.СH 2.СН(СО 2 Н) 2 = 2СО 2 + HO2C.CH2.CH2.CH2.CO2 H (глутаровая кислота)
и т. д. Как на частные случаи, можно указать на образование симметричной этантетракарбоновой кислоты при действии на мононатриймалоновый эфир бромистых изо— и псевдобутиленов: (Н 3 С) 2 СВr.СН 2 Br и Н 3 С.CHBr.СНBr.CH 3 (Ипатьев), реагирующих, следовательно, подобно свободному галоиду (см. выше), и при перегонке под уменьшенным давлением тетраэтилового эфира диоксалянтарной кислоты (Вислиценус и Бёклер), распадающегося при этом с выделением окиси углерода:
Наконец, некоторые из Ч. предельных кислот получены из пятиосновных при потере ими 1 молекулы СО 2; так, например, для получения бутилтетракарбоновой кислоты HO 2C.CH2 [CH(СО 2 Н)] 2.CH2.CO2 H сначала конденсируют малоновый эфир с аконитовым:
H2C(CO2C2H5)2 + (Н 5 С 2O2C).СН:C(СО 2 С 2 Н 5).CН 2.СО 2C2H5 = (Н 5 С 2O2C)2 СН.[CH.CО 2 С 2 Н 5]2.CH2.СО 2C2 Н 5,
или же эфир этенилтрикарбоновый и эфир фумаровой кислоты:
(Н 5 С 2O2C)2 СН.CH 2(CO2C2H5) + Н 5 С 2O2 С.СН:CH.СО 2 С 2H5 = (H5C2O2C)2CH.[CH.CO2C2H5]2.CH2.CO2C2H5,
a затем омыляют полученный пентаэтиловый эфир и нагревают кислоту до прекращения выделения СО 2. Некоторые из Ч. предельных жирных кислот известны в изомерных видоизменениях, принимаемых обыкновенно за случаи цистрансизомерии (ср. Стереоизомерия, Тетраметиленкарбоновые кислоты, Фумаровая кислота и Циклокислоты), но в большинстве случаев характер этой изомерии нельзя считать окончательно выясненным. Что касается Ч. жирных непредельных кислот, то более разработаны методы получения кислот ряда C nH2n-8 О 8 замкнутого строения (см. Циклокислоты). Из незамкнутых кислот кислота дикарбинтетракарбоновая (НО 2 С) 2 C:C(СО 2 Н) 2 образуется (в виде тетраэтилового эфира) при нагревании мононатриевого производного хлоромалонового эфира (Конрад и Гутцейт):
(H5C2O2C)2CNaCl + ClNaC(CO2C2H5)2 = 2NaCl + (H5C2O2C)2C:C(CO2C2H5)2,
при действии йода на динатрмалоновый эфир (Бишоф и Рах):
2(H5C2O2C)2CNa2 + 2I2 = (H5C2O2C)2 C:С(СО 2 С 2 Н 5)2 + 4NaI,
при нагревании мононатрмалонового эфира с монобромизоянтарным (Руэман):
2СН 3.CBr(СО 2 С 3 Н 5)2 + 2CHNa(CO2C2H5)2 = (H5C2O2C)2C:C(CO2C2H5)2 + 2СН 3.СН(СО 2 С 2 Н 5)2 + 2NaBr
и т. д.; тетраэтиловый эфир кристалличен; плавится при 58°, тетраметиловый кристаллизуется в длинных иглах, плавится при 121°; сама кислота очень непостоянна и при медленном нагревании, теряя 2СО 2, дает фумаровую кислоту С 6H4O8- 2СО 2=C4H4O4, а при быстром (Бишоф) — пироцинхоновую (ее ангидрид): 2С 6H4O8 =Н 2 О+6СО 2 +С 6 Н 6 О 3 (ср. Пиридин и Пиро...). Следующий член ряда — дикарбоксилглутаконовая кислота С 7 Н 6 О 8 известна (Конрад и Гутцейт, Гутцейт и Болам, Руэманн) только в виде эфира, получаемого при действии хлороформа на малоновый эфир в присутствии этилата натрия:
(H5C2O2C)2CHNa + Cl[CH]Cl2 + Na2(CO2C2H5)2 = 3NaCl + (H5C2O2C)2 СН.CН:С(СО 2 С 2 Н 5)2;
этот эфир, по-видимому, способен существовать в двух видоизменениях (Гутцейт); одно не дает ни окрашивания с эфирным раствором F 2Cl6, ни медного соединения; его Гутцейт называет настоящей эфирной, или кетоформой (см.); другой окрашивается от F 2Cl6 в синий цвет и дает с уксусно-медной солью желтовато-зеленое, растворимое в эфире соединение; ему Гутцейт приписывает строение:
и называет энольной формой (см. Псевдомерия и Энолизация). Омыление эфира протекает очень сложно и едва ли говорит в пользу однородности вещества; во всяком случае, кислоты C 7H6O8 при этом не получено. Другие члены ряда, за исключением циклокислот (см.), малоизвестны. Еще менее изучены Ч. кислоты ряда C nH2n-10 О 8; для следующего ряда C nH2n-12 О 8, кажется, неизвестно пока представителей. В ряду же ароматических Ч. кислот производных бензола известны только три кислоты ряда CnH2n-14 О 8, a именно изомеры формулы C 10H6 О 8 кислоты: меллофановая, пиромеллитовая и пренитовая. Меллофановая кислота — 1,2,3,5-бензолтетракарбоновая кислота (фентетраметиловая кислота) получена впервые Байером наряду с CO 2, тримезиновой и пренитовой кислотами при нагревании смеси гидро— и изогидропиромеллитовой (см. Меллитовая кислота) с крепкой H 2SO4; Якобсон получил ее окислением KМnО 4 1,2,3,5-тетраметилбензола; плавится при 238°, давая ангидрид; пиромеллитовая — 1,2,4,5-бензолтетракарбоновая кислота получена при сухой перегонке меллитовой кислоты (Эрдман) и при окислении 1,2,4,5-тетраметилбензола (Якобсон); плавится при 264°, образуя ангидрид (Байер), плавящийся при 286°; пренитовая кислота получена Байером вместе с меллофановой кислотой; она же получается при окислении KМnО 4 — 1,2,3,4-тетраметилбензола (Толь) и 1,2,3,4-тетраэтилбензола (Галь); плавится при 237°, тоже переходя в ангидрид; кислоты пиромеллитовая и пренитовая кристаллизуются из воды с 2H 2 O; описаны многочисленные производные этих кислот. Известно несколько Ч. ароматических кислот большой непредельности, а именно рядов C nH2n-16 О 8 и C nH2n-20 О 8.
А. И. Горбов.Δ .