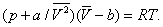
Ван-дер-Ваальса уравнение, одно из первых уравнений состояния реального газа, предложенное голландским физиком Я. Д. Ван-дер-Ваальсом (1873):
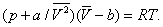
Здесь: р — давление газа; Т — его температура; 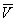 — объём одного моля вещества; R — универсальная газовая постоянная; а и b — константы, учитывающие отклонение свойств реального газа от свойств идеального. Член
— объём одного моля вещества; R — универсальная газовая постоянная; а и b — константы, учитывающие отклонение свойств реального газа от свойств идеального. Член  , имеющий размерность давления, учитывает притяжение между молекулами газа за счёт ван-дер-ваальсовых сил (см. Межмолекулярное взаимодействие). Константа b является поправкой на собственный объём молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. При больших
, имеющий размерность давления, учитывает притяжение между молекулами газа за счёт ван-дер-ваальсовых сил (см. Межмолекулярное взаимодействие). Константа b является поправкой на собственный объём молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. При больших 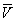 можно пренебречь обеими поправками и В. у. переходит в уравнение состояния идеального газа (см. Клапейрона уравнение).
можно пренебречь обеими поправками и В. у. переходит в уравнение состояния идеального газа (см. Клапейрона уравнение).
В. у. является приближённым и количественно описывает свойства реальных газов лишь в области высоких температур и низких давлений. Однако качественно оно позволяет описывать поведение газа при высоких давлениях, конденсацию газа в жидкость и критическое состояние (см. также Уравнение состояния).
На рис. изображено семейство изотерм (кривых зависимости р от 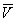 при постоянной температуре), рассчитанных по В. у. Это уравнение, кубическое относительно
при постоянной температуре), рассчитанных по В. у. Это уравнение, кубическое относительно 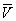 , имеет три корня. При низких температурах все три корня — действительные, а выше определённой температуры Тк, называемой критической, остаётся лишь один действительный корень. Физически это означает, что при Т > Тк вещество может находиться лишь в одном (газообразном) состоянии, а ниже Тк — в трёх состояниях (двух стабильных — жидком
, имеет три корня. При низких температурах все три корня — действительные, а выше определённой температуры Тк, называемой критической, остаётся лишь один действительный корень. Физически это означает, что при Т > Тк вещество может находиться лишь в одном (газообразном) состоянии, а ниже Тк — в трёх состояниях (двух стабильных — жидком  и газообразном
и газообразном  — и одном нестабильном). Графически это выражается так: при Т < Тк изотерма имеет три точки пересечения с прямой ac, параллельной оси объёмов. Точки прямой ac отвечают равновесию жидкости и её насыщенного пара. В условиях равновесия, например в состоянии, соответствующем точке b, относительные количества жидкости и пара определяются отношением отрезков bc/ba («правило моментов»). Равновесию фаз при определённой температуре соответствуют давление насыщенного пара рнп и интервал объёмов от
— и одном нестабильном). Графически это выражается так: при Т < Тк изотерма имеет три точки пересечения с прямой ac, параллельной оси объёмов. Точки прямой ac отвечают равновесию жидкости и её насыщенного пара. В условиях равновесия, например в состоянии, соответствующем точке b, относительные количества жидкости и пара определяются отношением отрезков bc/ba («правило моментов»). Равновесию фаз при определённой температуре соответствуют давление насыщенного пара рнп и интервал объёмов от 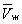 до
до 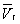 . При более низких давлениях (правее
. При более низких давлениях (правее 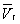 ) изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы отражает очень малую сжимаемость жидкости. Участки ad и ес относятся соответственно к перегретой жидкости и переохлажденному пару (метастабильные состояния). Участок de физически неосуществим, так как здесь происходит увеличение объёма при увеличении давления. Совокупность точек а, a', а»... и с, c', с»... определяет кривую, называемую бинодалью, которая очерчивает область совместного существования газа и жидкости. В критической точке К температура, давление и объём (Тк, рк,
) изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы отражает очень малую сжимаемость жидкости. Участки ad и ес относятся соответственно к перегретой жидкости и переохлажденному пару (метастабильные состояния). Участок de физически неосуществим, так как здесь происходит увеличение объёма при увеличении давления. Совокупность точек а, a', а»... и с, c', с»... определяет кривую, называемую бинодалью, которая очерчивает область совместного существования газа и жидкости. В критической точке К температура, давление и объём (Тк, рк, 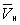 ) имеют значения, характерные для каждого вещества. Однако, если в В. у. ввести относительные величины: Т/Тк, Р/рк и
) имеют значения, характерные для каждого вещества. Однако, если в В. у. ввести относительные величины: Т/Тк, Р/рк и 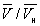 , то можно получить так называемое приведённое В. у., которое является универсальным, то есть не зависит от индивидуальных свойств вещества.
, то можно получить так называемое приведённое В. у., которое является универсальным, то есть не зависит от индивидуальных свойств вещества.
Лит.: Штрауф Е. А., Молекулярная физика, Л. — М., 1949; 3оммерфельд А., Термодинамика и статистическая физика, пер. с нем., М., 1955: Вукалович М. П. и Новиков И. И., Уравнение состояния реальных газов, М. — Л., 1948.
А. А. Лопаткин.

Диаграмма состояния вещества в координатах объем — давление ( , p): Т1, Т2, Т3, Тк — изотермы, рассчитаные по уравнению Ван-дер-Ваальса; К — критическая точка. Линия dke («спинодаль») очерчивает область неустойчивых состояний.
, p): Т1, Т2, Т3, Тк — изотермы, рассчитаные по уравнению Ван-дер-Ваальса; К — критическая точка. Линия dke («спинодаль») очерчивает область неустойчивых состояний.