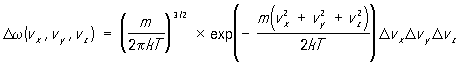 (1)
(1)Максвелла распределение, распределение по скоростям (или импульсам) молекул системы, находящейся в состоянии термодинамического равновесия. Впервые установлено Дж. К. Максвеллом в 1859. Согласно М. р., вероятность Dw (vx, vy, vz) того, что проекции скорости молекулы лежат в малых интервалах от vx до vx + Dvx, от vy до vy + Dvy и от vz до vz + Dvz определяется формулой:
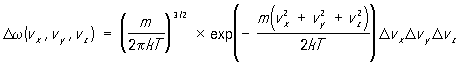 (1)
(1)
Здесь m — масса молекулы, Т — абсолютная температура системы, k — постоянная Больцмана.
Вероятность того, что абсолютное значение скорости лежит в интервале от v до v + Dv, вытекает из (1) и имеет вид:
 (2)
(2)
Эта вероятность достигает максимума при
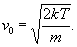
Скорость v0 называется наиболее вероятной. Чем ниже температура системы, тем большее число молекул имеют скорости, близкие к наиболее вероятной (см. рисунок).
Среднее число частиц в 1 см3 газа со скоростями в интервале от v до v + Dv равно Dn(v) = n0 Dw(v), где n0 — полное число частиц в 1 см3.
С помощью М. р. можно вычислять средние значения скоростей молекул и любых функций этих скоростей. В частности, средняя квадратичная скорость 
лишь немного (в  раз) превышает наиболее вероятную скорость. Например, для азота при Т » 300 К
раз) превышает наиболее вероятную скорость. Например, для азота при Т » 300 К 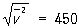 м/сек, a v0 » 360 м/сек.
м/сек, a v0 » 360 м/сек.
М. р. вытекает из Гиббса распределения канонического в том случае, когда поступательное движение частиц можно рассматривать в классическом приближении (см. Статистическая физика). М. р. не зависит от характера взаимодействия частиц системы и от внешних сил и потому справедливо как для молекул газа, так и для молекул жидкостей и твёрдых тел. М. р. справедливо также для броуновских частиц, взвешенных в газе или жидкости (см. Броуновское движение).
Экспериментальное подтверждение М. р. получено в опытах с молекулярными пучками.
Лит.: Кикоин И. К., Кикоин А. К., Молекулярная физика, М., 1963; Штрауф Е. А., Молекулярная физика, Л. — М., 1949.
Г. Я. Мякишев.

Распределение молекул азота по скоростям v при двух значениях абсолютной температуры T1 и T2; Dw/Dv — отношение вероятности того, что абсолютное значение скорости лежит в интервале от v до v + Dv к интервалу скорости Dv.