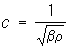 (здесь b — адиабатическая сжимаемость газа).
(здесь b — адиабатическая сжимаемость газа).Плотность (r), физическая величина, определяемая для однородного вещества его массой в единице объёма. П. неоднородного вещества — предел отношения массы к объёму, когда объём стягивается к точке, в которой определяется П.
Отношение П. двух веществ при определённых стандартных физических условиях называется относительной П.: для жидких и твёрдых веществ она обычно определяется по отношению к П. дистиллированной воды при 4 °С, для газов — по отношению к П. сухого воздуха или водорода при нормальных условиях. Средняя П. тела определяется отношением массы тела m к его объёму V, т. е. r = m/V. Единицей П. в СИ является кг/м3, в СГС системе единиц г/см3. На практике пользуются также внесистемными единицами П.: г/л, т/м3 и др.
Для измерения П. веществ применяют плотномеры, пикнометры, ареометры, гидростатическое взвешивание (см. Мора весы). Др. методы определения П. основаны на связи П. с параметрами состояния вещества или с зависимостью протекающих в веществе процессов от его П. Так, плотность идеального газа может быть вычислена по уравнению состояния r = pm/RT, где р — давление газа, m — его молекулярная масса (мольная масса), R — газовая постоянная, Т — абсолютная температура, или определена, например, по скорости распространения ультразвука 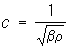 (здесь b — адиабатическая сжимаемость газа).
(здесь b — адиабатическая сжимаемость газа).
Диапазон значений П. природных тел и сред исключительно широк. Так, П. межзвёздной среды не превышает 10-21 кг/м3, средняя П. Солнца составляет 1410 кг/м3, Земли — 5520 кг/м3, наибольшая П. металлов — 22 500 кг/м3 (осмий), П. вещества атомных ядер — 1017 кг/м3, наконец, П. нейтронных звёзд может, по-видимому, достигать 1020 кг/м3.
Значения П. некоторых широко используемых веществ и материалов приведены в таблице. См. также Газы, Металлы.
Для пористых и сыпучих тел различают истинную П. (её определяют без учёта имеющихся в теле пустот) и кажущуюся П. (отношение массы тела ко всему занимаемому им объёму). П., как правило, уменьшается с ростом температуры (вследствие теплового расширения тел) и увеличивается с повышением давления. Аномально ведут себя, например, вода, чугун, аморфный кварц. Так, у воды П. имеет максимальное значение при 4 °C и уменьшается как с повышением, так и с понижением температуры. При агрегатных превращениях вещества П. изменяется скачком (см. Агрегатные состояния), причём при переходе из жидкого состояния в твёрдое П. обычно растет, однако у воды, например, она при затвердевании уменьшается.
Лит.: Справочник химика, 3 изд., т. 1, Л., 1971; Перельман В. И., Краткий справочник химика, 6 изд., М., 1963; Измерение массы, объёма и плотности, М., 1972: ГОСТ 2939—63. Газы. Условия для определения объёма.
С. Ш. Кивилис.
Плотность веществ, материалов и минералов, кг/м3
| Газы1 | Жидкости2 | Твердые вещества и материалы (средние значения)2 | |||
| Водород Н2 | 0,090 | Водород (—240°С) | 43,2 | Пробка | 240 |
| Гелий Не | 0,178 | Кислород (—200°С) | 122,5 | Древесина: |
|
| Метан CH4 | 0,717 | Бензин | 710 | берёзы (сухая) | 650 |
| Аммиак NH3 | 0,771 | Этиловый спирт С2Н6О | 789,4 | дуба (сухая) | 750 |
| Ацетилен С2Н2 | 1,171 | Ацетон С3Н6О | 791 | Парафин | 890 |
| Азот N2 | 1,251 | Скипидар | 865 | Лёд (0 °С) | 900 |
| Этилен С2Н4 | 1,260 | Растительные масла (15°С) | 914-962 | Текстолит | 1350 |
| Воздух (сухой) | 1,293 | Вода Н2О | 998,2 | Бетон | 2150 |
| Окись азота NO | 1,340 | Нитробензол C6H5NO2 | 1203 | Фарфор | 2350 |
| Кислород O2 | 1,429 | Уксусная кислота C2H4O2 | 1049 | Графит, стекло | 2500 |
| Хлористый водород HCl | 1,639 | Глицерин С3Н8О3 | 1260 | Гранит | 2600 |
| Двуокись углерода (углекислый газ) CO2 | 1,977 | Хлороформ СНСl3 | 1489 | Алюминий | 2700 |
| Двуокись серы (сернистый газ) SO2 | 2,927 | Азотная кислота HNO3 | 1510 | Слюда | 2900 |
| Хлор Сl2 | 3,214 | Четырёххлористый углерод ССl4 | 1594 | Корунд | 4000 |
| Ксенон Хе | 5,851 | Серная кислота H2SO4 | 1840 | Олово | 5850 |
| Радон Rn | 9,730 | Ртуть | 13546 | Сталь (углеродистая) | 7750 |
| Железо | 7874 | ||||
| Свинец | 11340 | ||||
| Вольфрам | 19300 | ||||
| Платина | 21450 | ||||
1 При температуре 0 °С и давлении р = 1,0332 кгс/см2 (101325 Па). 2 При 20 °С и р = 1 кгс/см2 (98066 Па).