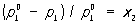 (1)
(1)Рауля законы, количественные зависимости, связывающие концентрацию раствора или с давлением насыщенного пара растворителя над раствором, или с изменением температуры кипения (замерзания) раствора. Один из законов Ф. Рауля гласит: относительное понижение парциального давления пара растворителя равно мольной доле растворённого вещества, т. е.
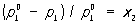 (1)
(1)
где  — давление насыщенного пара чистого растворителя при данной температуре, p1 — давление насыщенного пара растворителя над раствором, х2 — мольная доля растворённого вещества. В такой форме закон применим лишь к растворам, насыщенный пар которых ведёт себя как идеальный газ. Растворы, для которых соотношение (1) выполняется при всех концентрациях и при всех температурах в области существования раствора, часто называются идеальными (совершенными). В более общем случае в соотношении (1) должны использоваться не давления и концентрации, а летучести и активности. Для другого закона Рауля, по которому повышение температуры кипения (tкип) или понижение температуры замерзания (tк) раствора прямо пропорционально моляльной концентрации растворённого вещества, имеют место соотношения:
— давление насыщенного пара чистого растворителя при данной температуре, p1 — давление насыщенного пара растворителя над раствором, х2 — мольная доля растворённого вещества. В такой форме закон применим лишь к растворам, насыщенный пар которых ведёт себя как идеальный газ. Растворы, для которых соотношение (1) выполняется при всех концентрациях и при всех температурах в области существования раствора, часто называются идеальными (совершенными). В более общем случае в соотношении (1) должны использоваться не давления и концентрации, а летучести и активности. Для другого закона Рауля, по которому повышение температуры кипения (tкип) или понижение температуры замерзания (tк) раствора прямо пропорционально моляльной концентрации растворённого вещества, имеют место соотношения:
Dtкип = Еэ×m, Dtк = Eкm, (2)
где Dtкип — величина повышения tкип и Dtк — величина понижения tк, m — моляльная концентрация раствора, а Еэ и Ек — т. н. эбулиоскопическая (см. Эбулиоскопия) и криоскопическая (см. Криоскопия) постоянные растворителя (они приводятся во многих физико-химических таблицах). Соотношения (2) используют для определения молекулярной массы растворённого вещества по экспериментально определяемым величинам Dtкип и Dtк.
М. Е. Ерлыкина.