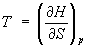 ,
,  .
.Энтальпия (от греч. enthálpo — нагреваю) (теплосодержание, тепловая функция Гиббса), потенциал термодинамический, характеризующий состояние термодинамической системы при выборе в качестве основных независимых переменных энтропии S и давления р. Обозначается H (S, р, N, xl), где N — число частиц системы, xi — другие макроскопические параметры системы. Э. — аддитивная функция, т. е. Э. всей системы равна сумме Э. составляющих её частей; с внутренней энергией U системы Э. связана соотношением
H = U + pV, (1)
где V — объём системы. Полный дифференциал Э. (при неизменных N и xi) имеет вид:
dH = TdS + Vdp. (2)
Из формулы (2) можно определить температуру Т и объем системы:
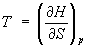 ,
,  .
.
При постоянном давлении (р = const.) теплоемкость системы
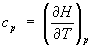
Эти свойства Э. при р = const аналогичны свойствам при постоянном объеме:
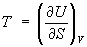 ,
, 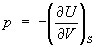 и
и  .
.
Равновесному состоянию системы в условиях постоянства S и р соответствует минимальное значение Э. Изменение Э. (DН) равно количеству теплоты, которое сообщают системе или отводят от нее при постоянном давлении, поэтому значения DН характеризуют тепловые эффекты фазовых переходов (плавления, кипения и т. д.), химических реакций и других процессов, протекающих при постоянном давлении. При тепловой изоляции тел (в условиях р = const) Э. сохраняется, поэтому ее называют иногда теплосодержанием или тепловой функцией. Условие сохранения Э. лежит, в частности, в основе теории Джоуля — Томсона эффекта, нашедшего важное практическое применение при сжижении газов. Термин «Э.» был предложен Х. Камерлинг-Оннесом.
Д. Н. Зубарев.