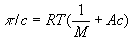 , где с — концентрация полимера по массе; А — коэффициент, зависящий от строения макромолекулы.
, где с — концентрация полимера по массе; А — коэффициент, зависящий от строения макромолекулы.Осмотическое давление, диффузное давление, термодинамический параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворённого вещества и растворителя. Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия — осмотическое всасывание растворителя через мембрану в раствор. В этом случае О. д. становится доступной для прямого измерения величиной, равной избыточному давлению, приложенному со стороны раствора при осмотическом равновесии (см. Осмос). О. д. обусловлено понижением химического потенциала растворителя в присутствии растворённого вещества. Тенденция системы выравнивать химические потенциалы во всех частях своего объёма и перейти в состояние с более низким уровнем свободной энергии вызывает осмотическое (диффузионный) перенос вещества. О. д. в идеальных и предельно разбавленных растворах не зависит от природы растворителя и растворённых веществ; при постоянной температуре оно определяется только числом «кинетических элементов» — ионов, молекул, ассоциатов или коллоидных частиц — в единице объёма раствора. Первые измерения О. д. произвёл В. Пфеффер (1877), исследуя водные растворы тростникового сахара. Его данные позволили Я. X. Вант-Гоффу установить (1887) зависимость О. д. от концентрации растворённого вещества, совпадающую по форме с Бойля — Мариотта законом для идеальных газов. Оказалось, что О. д. (p) численно равно давлению, которое оказало бы растворённое вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора. Для весьма разбавленных растворов недиссоциирующих веществ найденная закономерность с достаточной точностью описывается уравнением: pV = nRT, где n — число молей растворённого вещества в объёме раствора V; R — универсальная газовая постоянная; Т — абсолютная температура. В случае диссоциации вещества в растворе на ионы в правую часть уравнения вводится множитель i > 1, коэффициент Вант-Гоффа; при ассоциации растворённого вещества i < 1. О. д. реального раствора (p') всегда выше, чем идеального (p''), причём отношение p'/ p'' = g, называемое осмотическим коэффициентом, увеличивается с ростом концентрации. Растворы с одинаковым О. д. называется изотоническими или изоосмотическими. Так, различные кровезаменители и физиологические растворы изотоничны относительно внутренних жидкостей организма. Если один раствор в сравнении с другим имеет более высокое О. д., его называют гипертоническим, а имеющий более низкое О. д. — гипотоническим.
О. д. измеряют с помощью специальных приборов — осмометров. Различают статические и динамические методы измерения. Первый метод основан на определении избыточного гидростатического давления по высоте столба жидкости Н в трубке осмометров (рис.) после установления осмотического равновесия при равенстве внешних давлений pA и рБ в камерах А и Б. Второй метод сводится к измерению скоростей v всасывания и выдавливания растворителя из осмотической ячейки при различных значениях избыточного давления Dp = pA — рБ с последующей интерполяцией полученных данных к n = 0 при Dp = p. Многие осмометры позволяют использовать оба метода. Одна из главных трудностей в измерении О. д. — правильный подбор полупроницаемых мембран. Обычно применяют плёнки из целлофана, природных и синтетических полимеров, пористые керамические и стеклянные перегородки. Учение о методах и технике измерения О. д. называются осмометрией. Основное приложение осмометрии — определение молекулярной массы (М) полимеров. Значения М вычисляют из соотношения 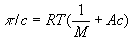 , где с — концентрация полимера по массе; А — коэффициент, зависящий от строения макромолекулы.
, где с — концентрация полимера по массе; А — коэффициент, зависящий от строения макромолекулы.
О. д. может достигать значительных величин. Например, 4%-ный раствор сахара при комнатной температуре имеет О. д. около 0,3 Мн/м2, а 53%-ный — около 10 Мн/м2; О. д. морской воды около 0,27 Мн/м2.
Л. А. Шиц.
О. д. в клетках животных, растений, микроорганизмов и в биологических жидкостях зависит от концентрации веществ, растворённых в их жидких средах. Солевой состав биологических жидкостей и клеток, характерный для организмов каждого вида, поддерживается избирательной проницаемостью биологических мембран для разных солей и активным транспортом ионов. Относительное постоянство О. д. обеспечивается водно-солевым обменом, т. е. всасыванием, распределением, потреблением и выделением воды и солей (см. Выделение, Выделительная система, Осморегуляция). У т. н. гиперосмотических организмов внутреннего О. д. больше внешнего, у гипоосмотических — меньше внешнего; у изоосмотических (пойкилоосмотических) внутреннее О. д. равно внешнему. В первом случае ноны активно поглощаются организмом и задерживаются в нём, а вода поступает через биологич. мембраны пассивно, в соответствии с осмотическим градиентом. Гиперосмотическая регуляция свойственна пресноводным организмам, мор. хрящевым рыбам (акулы, скаты) и всем растениям. У организмов с гипоосмотической регуляцией имеются приспособления для активного выделения солей. У костистых рыб преобладающие в океанических водах ионы Na+ и Cl— выделяются через жабры, у морских пресмыкающихся (змеи и черепахи) и у птиц — через особые солевые железы, расположенные в области головы. Ионы Mg2+, 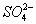 ,
, 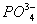 у этих организмов выделяются через почки. О. д. у гипер- и гипоосмотических организмов может создаваться как за счёт ионов, преобладающих во внешней среде, так и продуктов обмена. Например, у акуловых рыб и скатов О. д. на 60% создаётся за счёт мочевины и триметиламмония; в плазме крови млекопитающих — главным образом за счёт ионов Na+ и Cl—; в личинках насекомых — за счёт разнообразных низкомолекулярных метаболитов. У морских одноклеточных, иглокожих, головоногих моллюсков, миксин и др. изоосмотических организмов, у которых О. д. определяется О. д. внешней среды и равно ему, механизмы осморегуляции отсутствуют (исключая клеточные).
у этих организмов выделяются через почки. О. д. у гипер- и гипоосмотических организмов может создаваться как за счёт ионов, преобладающих во внешней среде, так и продуктов обмена. Например, у акуловых рыб и скатов О. д. на 60% создаётся за счёт мочевины и триметиламмония; в плазме крови млекопитающих — главным образом за счёт ионов Na+ и Cl—; в личинках насекомых — за счёт разнообразных низкомолекулярных метаболитов. У морских одноклеточных, иглокожих, головоногих моллюсков, миксин и др. изоосмотических организмов, у которых О. д. определяется О. д. внешней среды и равно ему, механизмы осморегуляции отсутствуют (исключая клеточные).
Диапазон средних величин О. д. в клетках организмов, не способных поддерживать осмотический гомеостаз, довольно широк и зависит от вида и возраста организма, типа клеток и О. д. окружающей среды. В оптимальных условиях О. д. клеточного сока наземных органов болотных растений колеблется от 2 до 16 ат, у степных — от 8 до 40 ат. В разных клетках растения О. д. может резко различаться (так, у мангровых О. д. клеточного сока около 60 ат, а О. д. в сосудах ксилемы не превышает 1—2 ат). У гомойосмотических организмов, т. е. способных поддерживать относительное постоянство О. д., средней величины и диапазон колебаний О. д. различны (дождевой червь — 3,6—4,8 ат, пресноводные рыбы — 6,0—6,6, океанические костистые рыбы — 7,8—8,5, акуловые — 22,3—23,2, млекопитающие — 6,6—8,0 ат). У млекопитающих О. д. большинства биологических жидкостей равно О. д. крови (исключение составляют жидкости, выделяемые некоторыми железами, — слюна, пот, моча и др.). О. д., создаваемое в клетках животных высокомолекулярными соединениями (белки, полисахариды и др.), незначительно, но играет важную роль в обмене веществ (см. Онкотическое давление).
Ю. В. Наточин, В. В. Кабанов.
Лит.: Мелвин-Хьюз Э. А., Физическая химия, пер. с англ., кн. 1—2, М., 1962; Курс физической химии, под ред. Я. И. Герасимова, т. 1—2, М. — Л., 1963—1966; Пасынский А. Г., Коллоидная химия, 3 изд., М., 1968: Проссер Л., Браун Ф., Сравнительная физиология животных, пер. с англ., М., 1967; Гриффин Д., Новик Эл., Живой организм, пер. с англ., 1973; Нобел П., Физиология растительной клетки (физико-химический подход), пер. с англ., М., 1973.
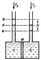
Принципиальная схема осмометра: А — камера для раствора; Б — камера для растворителя; М — мембрана. Уровни жидкости в трубках при осмотическом равновесии: а и б — в условиях равенства внешних давлений в камерах А и Б, когда rА = rБ, при этом Н — столб жидкости, уравновешивающий осмотическое давление; б — в условиях неравенства внешних давлений, когда rА — rБ = p.